قبل از اینکه ساختار پایه اجسام شیمیایی بنا نهاده شود، ترکیبات با نام افراد، محلها، و خواص ویژه نامگذاری شده بودند. برای نمونه نمک گلوبر (سدیم سولفات، کشف شده توسط جی. آر. گلوبر)، نمک آمونیاک (آمونیوم کلرید، برگرفته شده از نام خدای باستانی مصری آمون از معبد نزدیک مکان بوجود آمده جسم)، و سودا شوینده (سدیم کربنات، استفاده شده برای نرم کردن آب شستشو) را می توان ذکر کرد. امروزه میلیونها ترکیبات متعدد شناخته شده اند و هزاران ترکیب دیگر نیز سالانه کشف می شوند. بدون یک سیستم نامگذاری ترکیبات، نوشتن نام ، با این زیادی اجسام یک وظیفه نا امید کننده خواهد شد. نامگذاری شیمیایی نامگذاری سیستماتیک ترکیبات شیمیایی است.
اگر یک ترکیب در تقسیم بندی آلی قرار نگیرد، آن ترکیب بایستی معدنی باشد. ترکیبات معدنی ترکیبات عناصر دیگر غیر از کربن هستند. تعداد کمی استثنا در این شکل طبقه بندی شامل کربن مونو کسید، کربن دی اکسید، کربناتها، و سیانیدها می شوند؛ که همگی دارای کربن هستند و بطور کلی هنوز جزو معدنی ها محسوب می شوند.
در این بخش، ما در مورد نامگذاری تعدادی از ترکیبات معدنی ساده بحث خواهیم کرد. در ابتدا ما به نامگذاری ترکیبات یونی، بعد از آن، به تعدادی از ترکیبات مولکولی ساده، شامل ترکیبات مولکولی دوتایی (ترکیبات مولکولی دو عنصری) و اسیدها، و در نهایت، به هیدراتهای ترکیبات یونی خواهیم پرداخت. هیدراتهای ترکیبات یونی دارای مولکولهای آب آزاد همراه با ترکیبات یونی هستند.
همانطوریکه ما در بخش قبلی دیدیم، ترکیبات یونی، اجسامی هستند که از یونها تشکیل شده اند. اغلب ترکیبات یونی شامل اتمهای یک فلز و یک غیر فلز، برای مثال،NaCl می شوند. (نمکهای آمونیوم، مانند NH4Cl، یک استثنا برجسته هستند.) شما نامگذاری یک ترکیب یونی را با نامیدن کاتیون آن در اول و سپس آنیون آن در ادامه انجام می دهید. برای مثال،
پتاسیم سولفات
نام کاتیون نام آنیون
قبل از اینکه شما بتوانید ترکیبات یونی را نامگذاری کنید، شما باید توانایی نوشتن نام یونها را داشته باشید.
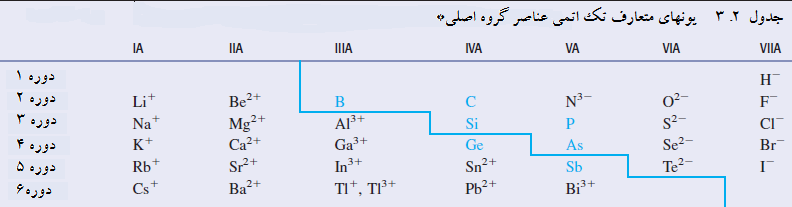
ساده ترین یونها تک اتمی هستند. یک یون تک اتمی یونی تشکیل شده از یک اتم است. جدول یونهای تک اتمی معمول عناصر گروه اصلی را فهرست کرده است. قبل از اینکه شما به جدول نگاه کنید اول شما با قواعد پیشگویی بار روی چنین یونهایی و سپس به قواعد نامگذاری یونهای تک اتمی آشنا شوید.
قواعد پیشگویی بار یونهای تک اتمی
1. اغلب عناصر فلزی گروه اصلی یک کاتیون تک اتمی با بار برابر شماره گروه در جدول تناوبی (عدد رومی) را دارند. مثال: آلومینیوم، در گروه IIIA، یون تک اتمی Al3+ دارد.
2. تعدادی از عناصر فلزی با عدد اتمی بالا از قاعده قبلی استثنا هستند؛ آنها بیش از یک کاتیون دارند. این عناصر علاوه بر داشتن کاتیون با بار برابر شماره گروه، کاتیون متعارف با بار برابر شماره گروه منها 2 را نیز دارند. مثال: کاتیون متعارف سرب Pb2+ است. (شماره گروه 4 است؛ بار 2-4 است.) علاوه بر ترکیبات دارای Pb2+، برخی ترکیبات سرب دارای Pb4+ هستند.
3. اغلب فلزات واسطه بیش از یک کاتیون تک اتمی با بار متفاوت تشکیل می دهند. بیشتر این عناصر یک یون با بار 2+ دارند. مثال: آهن کاتیونهای متعارف Fe2+ و Fe3+ را دارد. مس کاینونهای متعارف Cu+ و Cu2+ را دارد.
4. بار آنیون تک اتمی برای یک عنصر غیر فلزی گروه اصلی برابر با شماره گروه منهای 8 است. مثال: اکسیژن آنیون تک اتمی O2- را دارد. (شماره گروه 6 است: بار 8-6 است.)
عناصر نشان داده شده رنگی ترکیبات یونهای تک اتمی ندارند.