اگر چه اکثر اجسام مولکولی هستند، ولی بقیه از یونها تشکیل شده اند. یک یون یک ذره باردار است که از یک اتم یا گروهی از اتمهای متصل شده شیمیایی با اضافه شدن یا حذف الکترون بدست آمده است. سدیم کلرید جسم ساخته شده از یونها است.
گر چه اتمهای مجزا بطور عادی الکتریکی خنثی هستند و بنابراین تعداد مساوی از بارهای مثبت و منفی دارند، در موقع تشکیل ترکیبات معین اتمها می توانند یون بشوند. اتمهای فلزات تمایل بدست دادن الکترونها دارند، در حالیکه نا فلزات تمایل به گرفتن الکترون را دارند. وقتی یک اتم فلز نظیر سدیم و یک اتم نافلز نظیر کلر به یکدیگر نزدیک می شوند، یک الکترون می توانداز اتم فلز به اتم نا فلز برای تشکیل یونها منتقل می شود.
یک اتم که یک الکترون بیرونی را می گیرد یک یون با بار منفی می شود، که آنیون نامیده می شود. یک اتم که یک الکترون را می دهد یک یون با بار مثبت می شود، که کاتیون نامیده می شود. بطور مثال، اتم سدیم برای تشکیل کاتیون سدیم (Na+) می تواند یک الکترون بدهد. یک اتم کلر برای تشکیل آنیون کلرید (-Cl) می تواند یک الکترون بگیرد. یک اتم کلسیم می تواند برای تشکیل کاتیون کلسیم Ca2+ دو الکترون بدهد. توجه شود که دو بار مثبت روی یون با بالا نویس +2 نشان داده شده است.
بعضی از یونها دو یا چند اتم متصل شده شیمیایی دارند اما دارای زیادی یا کمبود الکترون هستند، در نتیجه واحد بار الکتریکی دارد. یک مثال، یون سولفات، SO42- است. بالا نویس -2 دو الکترون اضافی را روی گروه اتمها را نشان می دهد.
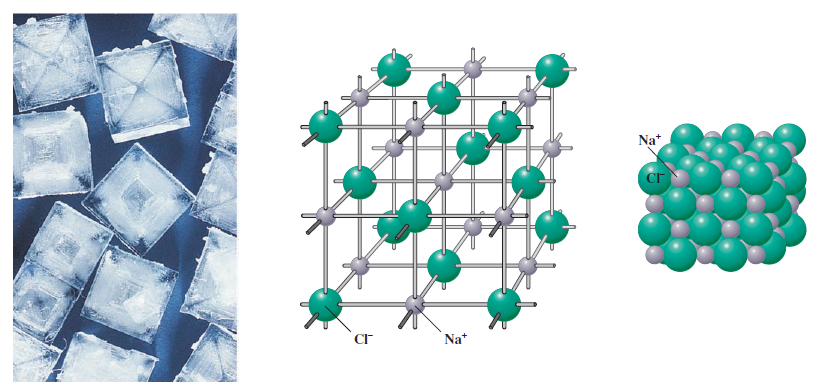
یک ترکیب یونی ترکیب تشکیل شده از کاتیونها و آنیونها است. سدیم کلرید تعداد مساوی از یونهای، Na+، و یونهای کلرید، -Cl، را دارد. نیروی جاذبه بین بارهای منفی و مثبت یونها را باهم با ارایش منظم در فضا کنار هم نگه می دارد. برای مثال، در سدیم کلرید، هر یون Na+، با شش یون –Cl و هر یون –Cl با شش یون Na+، احاطه شده است. نتیجه، یک بلور است، که نوعی جامد دارای آرایش سه بعدی منظم از اتمها، مولکولها، یا (در مورد سدیم کلرید) یونها است. شکل 1 بلورهای سدیم کلرید و دو نوع مدل استفاده شده برای نشان دادن آرایش یونها در بلور را نشان می دهد. تعداد یونها در بلور سدیم منحصر بفرد اندازه بلور را تعیین می کند.
فرمول ترکیب یونی با مشخص کردن کوچکترین عدد صحیح ممکن یونهای مختلف در جسم ، با حذف بار یونها است، بنابراین فرمولها فقط اتمهای موجود را نشان می دهد. برای مثال، سدیم کلرید تعداد مساوی از یونهای Na+ و –Cl را دارد. فرمول NaCl (نه –Cl Na+ ) نوشته می شود. آهن(III) سولفات ترکیبی است از یونهای آهن(III)،+Fe3، و یونهای سولفات، SO42-، به نسبت 2:3 است. فرمول به صورت Fe2(SO4)3 است، که پرانتزها فرمول یک ترکیب یونی بیش از یک اتم (بعلاوه بار یونها حذف شده است) را در برمی گیرد؛ پرانتزها فقط وقتی که دو یا چند تا یون این چنینی وجود دارد نیاز است.
شکل
بلور سدیم کلرید
چپ: تصاویر نشان دهنده بلورهای سدیم کلرید. وسط: مدل بخشی از بلور با آرایش منظم یونهای سدیم و یونهای کلرید. هر یون سدیم با شش یون کلرید، و هر یون کلرید با شش یون سدیم احاطه شده است. راست: مدل مشخصی از آرایش یونهای سدیم و کلرید در بلور سدیم کلرید جامد
گر چه اجسام یونی مولکول ندارند، ما می توانیم ما از کوچکترین واحد چنین جسمی صحبت بکنیم. واحد فرمولی یک جسم گروهی از اتمها یا یونها که بطور روشنی در فرمول نمادینه شده است. برای مثال، واحد فرمولی آب، H2O، مولکول H2O است. واحد فرمولی آهن(III) سولفات، Fe2(SO4)3 شامل دو یون +Fe3 و سه یون SO42- می شود. واحد فرمولی کوچکترین واحد چنین جسمی است.
همه اجسام، شامل ترکیبات یونی، از نظر الکتریکی خنثی هستند. شما از این واقعیت می توانید برای بدست آوردن فرمول ترکیب یونی، با توجه به فرمول یونها را بدست آورید. در مثال ذیل این مطلب نشان داده شده است.