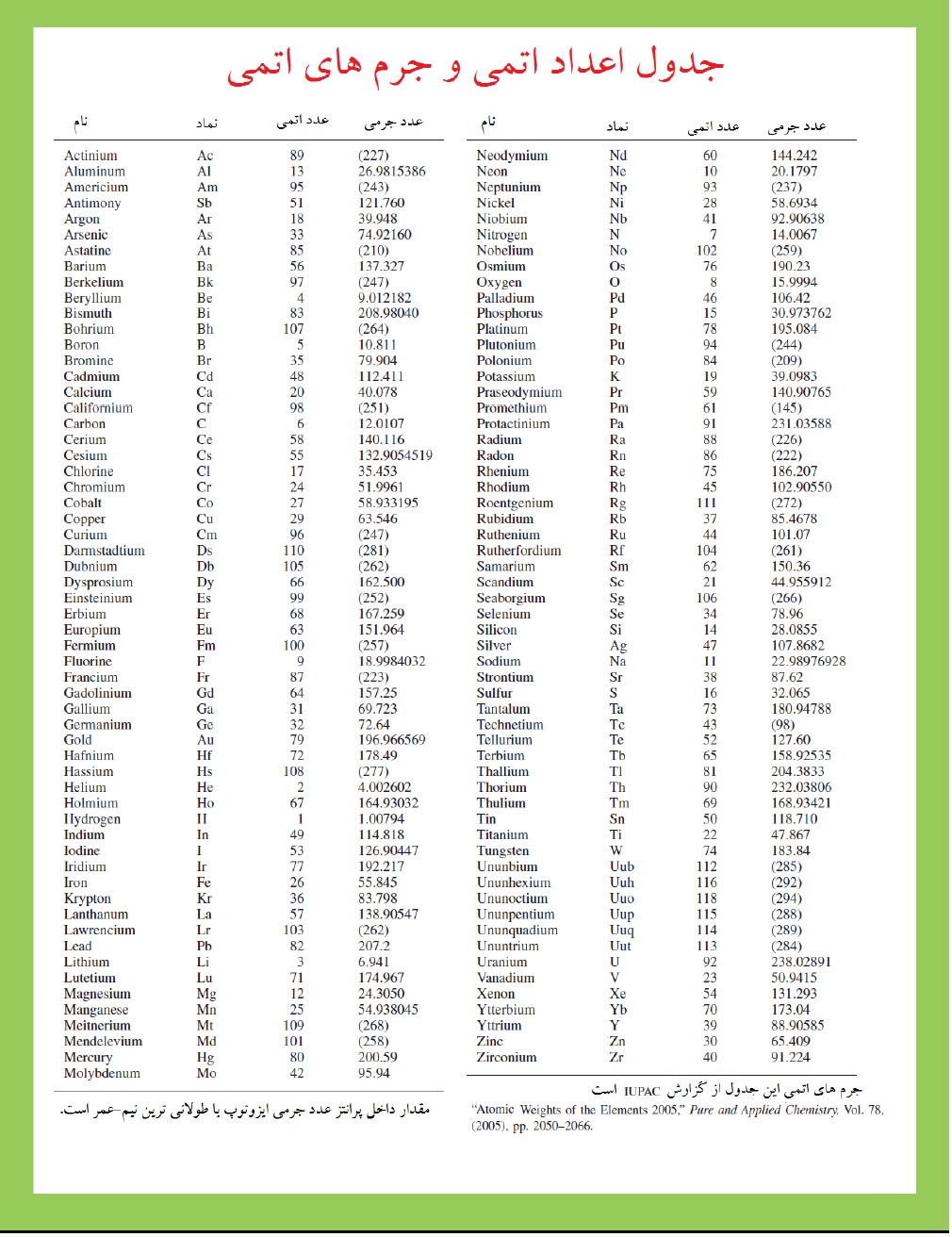
حرف اصلی نظریه اتمی دالتون ایده ای بود که یک اتم یک عنصر جرم مشخصی دارد. ما حالا می دانیم که عناصر طبیعی موجود مخلوطی از ایزوتوپها هستند، هر ایزوتوپ دارای جرم خاص خودش است. گرچه، درصد ایزوتوپهای مختلف در اغلب عناصر طبیعی موجود بطور اساسی با مرور زمان ثابت باقی مانده و در اغلب موارد از منبع عنصر مستقل است. بدین ترتیب، جرمی که دالتون عملا محاسبه کرد میانگین جرمهای اتمی بود (عملا میانگین جرمهای نسبی، که ما بحث خواهیم کرد). از آنجاییکه شما بطور معمولی با مخلوط طبیعی موجود عناصر سرو کار دارید (خواه در شکل خالص خواه به شکل ترکیبات)، در حقیقت شما به میانگین جرمهای اتمی در کار شیمیایی نیاز خواهید داشت.
برخی تغییر ترکیب ایزوتوپی در تعدادی عناصر رخ می دهد و این اهمیت میانگین جرم اتمی آن را محدود می کند.
جرمهای اتمی نسبی
دالتون نتوانست اتم تنهایی را وزن کند. وی چطور می توانست میانگین جرم یک اتم را نسبت به میانگین جرم یک اتم دیگر بیابد. ما این جرمهای اتمی نسبی را به صورت جرمهای اتمی در نظر خواهیم گرفت. برای اینکه ببنید دالتون چطور جرمهای اتمی را بدست آورد، فرض کنید شما گاز هیدروژن را در اکسیژن می سوزانید. محصول این واکنش آب ، که ترکیبی از هیدروژن و اکسیژن است. در آزمایش، شما بدست آوردید که 1/0000 گرم از هیدروژن با g 7/9367 اکسیژن برای تشکیل آب واکنش می دهد. برای بدست آوردن جرم اتمی اکسیژن (نسبت به هیدروژن)، شما به فهمیدن نسبت تعداد اتمهای هیدروژن به تعداد اتمهای اکسیژن در آب نیاز دارید. همانطوریکه که ممکن است شما فرض کنید، دالتون با این مشکل داشت. امروزه ما می دانیم که آب دارای دو اتم هیدروژن برای یک اتم اکسیژن است. بنابراین جرم اتمی اکسیژن 873/ 15=7/9367 ×2 برابر میانگین جرم اتم هیدروژن است.
دالتون فرض کرد که فرمول آب HO است. با استفاده از این فرمول و اطلاعات دقیق او وزن میانگین اتمی اکسیژن را 7/9367 بدست آورده بود.
واحدهای جرم اتمی
سرانجام مقیاس جرم اتمی بر پایه هیدروژن دالتون با مقیاس بر پایه اکسیژن و سپس، در 1961، با مقیاس جرم کربن-12 فعلی جایگزین شد. این مقیاس به اندازه گیری جرم اتمی با دستگاهی بنام طیف سنج جرمی، که ما آن را بطور خلاصه در بخش بعدی توضیح خواهیم داد، بستگی دارد. شما اندازه گیری دقیق جرمها را با این دستگاه با مقایسه کردن جرم یک اتم به جرم یک اتم خاص انتخاب شده به عنوان استاندارد انجام می دهید. با مقیاس جرم اتمی فعلی، ایزوتوپ کربن-12 به عنوان استاندارد اتنخاب شده است و بطور قراردادی 12 برای واحد جرم اتمی تعیین شده است. بنابراین، واحد جرم اتمی (amu) واحد جرم برابر با یک دوازدهم جرم یک اتم کربن-12 است.
در این مقیاس جدید، جرم اتمی یک عنصر میانگین جرم اتمی عنصر طبیعی موجود، بیان شده در واحد جرم اتمی است. جدول کامل جرمهای اتمی در ذیل آمده است. (جرم اتمی بعضی وقتها با وزن اتمی بیان می شود. گرچه، استفاده از اصطلاح وزن در وزن اتمی اکیدا صحیح نیست، با قرارداد به معنی "میانگین جرم اتمی" مجاز شده است.)
مثال 1 نوشتن نمادهای هسته
نماد هسته برای یک هسته که 38 پروتون و 50 نوترون دارد، چه هست؟
استراتژی مسئله برای حل این مسئله، ما باید در ذهن داشته باشیم که تعداد پروتونها در هسته (عدد اتمی) به صورت منحصر بفردی سبب شناسایی یک عنصر می شود و عدد جرمی مجموع پروتون ها و نوترونها است.
حل از جدول اعداد اتمی و اعداد جرمی پشت جلد داخلی کتاب، ما متوجه خواهیم شد که عنصر با عدد اتمی 38 استرونسیم، نماد Sr است. عدد جرمی 88=50+38 است. نماد ![]() است.
است.
بررسی جواب در موقع نوشتن نمادهای عنصری به صورتی که شما اینجا انجام دادید، مطمئن باشید که شما همیشه فقط حرف اول نماد را بزرگ می نویسید.
تمرین 1
یک هسته دارای 17 پروتون و 18 الکترون است. نماد هسته اش چه هست؟
مسئله 1
نماد هسته برای هسته ای با 14 پروتون و 14 نوترون چیست؟
مسئله 2
یک اتم دارای 11 پروتون و 11 نوترون دارد. نماد هسته اتم چیست؟
مسئله 3
لیتیم موجود طبیعی مخلوطی از ![]() و
و ![]() است. تعداد پروتونها، نوترونها، و الکترونها در هر اتم ایزوتوپ چقدر است؟
است. تعداد پروتونها، نوترونها، و الکترونها در هر اتم ایزوتوپ چقدر است؟
مسئله 4
کلر موجود طبیعی مخلوطی از ایزوتوپهای Cl-35 و Cl-37 است. چند پروتون و چند نوترون در هر ایزوتوپ وجود دارد؟ چند الکترون در اتم طبیعی وجود دارد؟
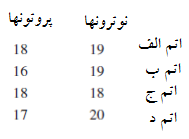
مسئله 5
جدول ذیل تعداد پروتونها و نوترونها را در هسته اتم های متعدد نشان می دهد. کدام اتم ایزوتوپ اتم A است؟ کدام اتم عدد جرمی اتم A را دارد.
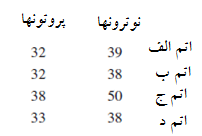
مسئله 6
جدول ذیل تعداد پروتونها و نوترونها را در هسته اتم های متعدد نشان می دهد. کدام اتم ایزوتوپ اتم A است؟ کدام اتم عدد جرمی اتم A را دارد.
ساختار هسته ای؛ ایزوتوپ ها
هسته یک اتم هم ساختار دارد؛ هسته از دو نوع ذره مختلف، پروتونها و نوترونها تشکیل شده است. الگوی آزمایش پراکندگی ذرات آلفا علاوه بر اینکه منجر به مدل هسته ای اتم شد، برای روشن شدن این ساختار هسته هم مفید شد.
یک خاصیت مهم هسته بار الکتریکی آن است. یک روش برای تعیین مقدار بار مثبت هسته آنالیز توزیع پراکندگی ذرات آلفا از ورقه فلزی است؛ همچنین آزمایشهای دیگر بار هسته را فراهم می نماید. محققین، با چنین آزمایشهایی کشف کردند که هر عنصر بار هسته ای منحصر بفردی دارد که برابر با حاصلضرب یک عدد صحیح در مقدار بار الکترون است. این عدد صحیح، که مختص یک عنصر است، عدد اتمی (Z) نامیده شده است. هسته اتم هیدروژن، که دارای مقدار بار برابر با الکترون است، کوچکترین عدد اتمی 1 را دارد.
در 1919، رادرفورد کشف کرد که هسته هیدروژن، یا آن چیزی که ما حالا پروتون می نامیم، در موقع برخورد ذرات آلفا به بعضی عناصر سبکتر نظیر تیتروژن تشکیل می شود. یک پروتون یک ذره هسته ای دارای بار مثبت برابر با بار الکترون و جرمش 1800 برابر جرم الکترون است. وقتی یک ذره آلفا به اتم نیتروژن برخورد می کند، یک پروتون از هسته نیتروژن بیرون می آید. پروتونها در هسته به هسته بار مثبت می دهد.
بنابراین عدد اتمی (Z) تعداد پروتونها در هسته یک اتم است. به علت اینکه شما می توانید بطور آزمایشگاهی عدد اتمی را تعیین کنید، شما می توانید بطور دقیقی تعیین کنید که یک نمونه یک عنصر خالص است یا شاید شما یک عنصر جدید را کشف کرده باشید. حالا ما می توانیم تعریفی از یک عنصر را با دقت زیادی بیان کنیم. یک عنصر جسمی است که همه اتم هایش عدد اتمی یکسانی را دارند.
همچنین نوترون با آزمایشهای پراکندگی ذرات آلفا کشف شده است. وقتی فلز بریلیم تحت تابش اشعه آلفا قرار گرفته است، یک تابش نافذ از فلز بدست آمده است. فیزیکدان بریتانیایی جیمز چادویک (1974-1891) نشان داد که این تابش نافذ حاوی ذرات خنثی، یا نوترون هاست. نوترون یک ذره هسته ای دارای جرم یکسان پروتون را دارد ولی بار الکتریکی ندارد. وقتی ذرات آلفا به هسته اتم برخورد می کند، نوترون ها بیرون رانده می شوند. جدول 2. 1 جرم ها و بارهای الکترون و ذرات هسته ای، پروتون و نوترون را مقایسه می کند.
جدول 2. 1 خواص الکترون، پروتون، و نوترون
ذره (kg) جرم (amu )* (C) جرم (e) بار
الکترون 31-10×10939/9 19-10×60218/1- 0/00055 l1-
پروتون 27-10×67262/1 19-10×60218/1+ 1/00726 1+
نوترون 27-10×67493/1 0 1/00866 0
*واحد جرم اتمی (amu) برابر با kg1/66054 ×10-27 است.
حالا هسته چند اتم، بطور مثال سدیم موجود طبیعی را در نظر بگیرید. هسته دارای 11 پروتون و 12 نوترون است. بدین ترتیب، بار هسته سدیم e11+ است، که ما معمولا بطور ساده ای 11+ می نویسیم که به معنی 11 واحد بار الکترون e است. بطور مشابهی آلومینیم موجود طبیعی دارای 13 پروتون و 14 نوترون است، که بار مثبت هسته e13+ است.
ما یک هسته را با عدد اتمی (Z) و عدد جرمیش (A) مشخص می کنیم. عدد جرمی (A) عدد کل پروتونها و نوترونها در هسته است. هسته سدیم طبیعی موجود عدد اتمی 11 و عدد جرمی 23 (12+11) دارد.
هسته یک اتم با عدد اتمی و عدد جرمی مشخص می شود. نماد مختصر نویسی شده برای هر هسته حاوی نماد عنصر با عدد اتمی نوشته شده به صورت زیر نویس در چپ و عدد جرمی به صورت بالا نویس در چپ است. شما نماد هسته ای برای هسته سدیم موجود طبیعی را به صورت ذیل می نویسید.
یک اتم معمولا بطور الکتریکی خنثی است، بنابراین الکترون های اطراف هسته اتم به تعداد پروتونهای هسته اتم است: که تعداد الکترونها در یک اتم خنثی برابر عدد اتمی است. یک اتم سدیم هسته اش بار 11+ دارد، و اطراف این هسته 11 الکترون (با بار 11-، اتم با بار 0) وجود دارد.
همه هسته های اتم عناصر خاص عدد اتمی یکسان دارند، ولی ممکن است هسته اتم عدد جرمی متفاوت داشته باشد. ایزوتوپها اتم هایی هستند که هسته های اتم عدد اتمی یکسان ولی اعداد جرمی متفاوت دارند؛ که هسته به تعداد یکسان پروتون دارد، ولی تعداد نوترونها متفاوت است. سدیم فقط یک ایزوتوپ موجود طبیعی دارد، که ما همان نماد که برای هسته استفاده کردیم، مشخص می کنیم؛ همچنین ما آن را ایزوتوپ سدیم-23 می نامیم. اکسیژن موجود طبیعی مخلوطی از ایزوتوپ ها است: حاوی 99/759% اکسیژن-16، 0/037%اکسیژن-17، و 0/204% اکسیژن-18 است.
ایزوتوپ ها برای اولین بار در حدود 1912 مورد شک قرار گرفتند وقتی عناصر شیمیایی یکسان با عدد های جرمی متفاوت در مواد رادیواکتیو پیدا شده بودند. گرچه، مدرک خیلی متقاعد کننده از طیف سنج جرمی، بدست آمده بود.
شکل زیر ممکن است به شما برای تجسم کردن ارتباط میان ذرات زیر اتمی متفاوت در ایزوتوپهای یک عنصر کمک کند. اندازه هسته ها نشان داده شده در شکل به منظور نشان دادن تعداد پروتونها و نوترونها خیلی بزرگنمایی شده است. در حقیقت، فضای گرفته شده با هسته در مقایسه با ناحیه اشغال شده با الکترونها کوچک است. گرچه، الکترونها ذرات خیلی سبک هستند، در کل نسبتا ناحیه پخش شده بزرگ، یا "لایه های" اطراف هسته یک اتم حرکت می کنند.
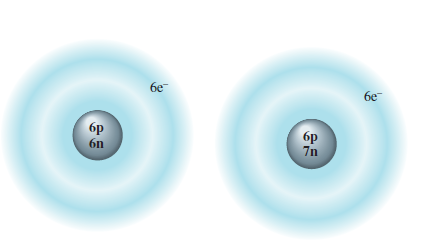
شکل 2. 9
نمایشی از دو ایزوتوپ کربن
شکل ذرات اصلی سازنده ایزوتوپهای کربن-12 و کربن-13 را نشان می دهد. (اندازه های نسبی در اینجا خیلی بزرگنمایی شده است.)
مدل هسته ای اتم
ارنست رادرفورد (1937-1871)، فیزیکدان بریتانیایی، ایده جدید مدل هسته ای اتم را در 1911 بر اساس آزمایشهای انجام گرفته در آزمایشگاهش توسط هانس گیگر و ارنست مارسدین ارائه کرد. این دانشمندان اثر بمباران ورق نازک طلا (و صفحات فلزی دیگر) با اشعه آلفا تولید شده از مواد رادیو اکتیو نظیر اورانیوم (شکل 1) را مشاهده کردند. قبلا رادرفورد نشان داده بود که اشعه آلفا شامل ذرات باردار مثبت است. گیگر و مارسدین دریافتند که اغلب ذرات آلفا از میان صفحه فلزی عبور کردند و در نتیجه در قسمتهایی که عبور انجام گرفت چیزی وجود ندارد. ولی تعدادی (تقریبا 1 در 8000) با زوایای بزرگ پراکنده و کمی هم برگشتند.
مطابق با مدل رادرفورد، اغلب جرم اتم (99/95% یا بیشترش) در مرکز با بار مثبت، یا هسته، که اطرافش الکترون با بار منفی حرکت می کند، متمرکز شده است. با وجود اینکه قسمت اعظم جرم یک اتم در هسته اش است، هسته فقط قسمت خیلی کوچکی از فضای اتم را اشغال می کند. هسته قطر حدود pm 10-3 ) m 10-15) دارد، در حالیکه قطر اتمی m 10-10، صد هزار مرتبه بزرگتر است. اگر شما از توپ گلف برای نشان دادن هسته استفاده نمایید، قطر اتم حدود 3 مایل خواهد شد.
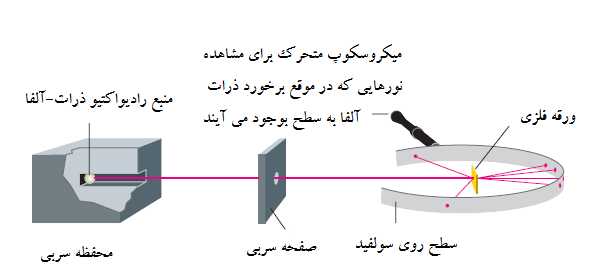
شکل 1
پراکندگی ذرات-آلفا از ورقه های فلزی
اشعه آلفا از منبع رادیواکتیو تولید شده و با یک صفحه سربی دارای سوراخ به صورت پرتو درآمده است. (سرب اشعه را جذب می کند.) ذرات آلفا پراش شده با سطح روی سولفید مرئی شده اند، که به صورت تشعشع های ریز منتشر می شوند وقتی که ذرات به آن برخورد می کنند. یک میکروسکوپ متحرک برای دیدن تشعشع ها استفاده شده است.
مدل هسته ای اتم به راحتی نتایج بمباران کردن ورقه طلا و سایر ورقه های فلزی را با ذرات آلفا توضیح می دهد. ذرات آلفا خیلی سبکتر از اتم های طلا هستند. (ذرات آلفا هسته هلیم هستند.) بیشتر ذرات آلفا از میان اتم های فلزی بدون منحرف شدن با الکترون های سبک وزن عبور می کنند. گرچه، وقتی یک ذره آلفا به هسته اتم فلزی اصابت می کند، با یک زوایه وسیع پراکنده می شود، زیرا که با هسته با بار مثبت بزرگ منحرف می شود (شکل 2).
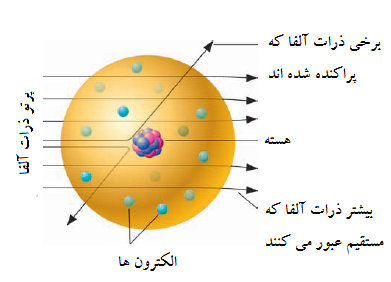
شکل 2
نمایش پراکندگی ذرات-آلفا با ورقه طلا
بیشتر ذرات آلفا از ورقه بدون انحراف عبور می کنند. گرچه تعداد کمی از ذرات آلفا با هسته برخورد کرده و با زاویه بزرگ پراکنده شده اند. (اندازه نسبی هسته کوچک تر از اینی است که ذر اینجا نشان داده شده است.)
با وجود اینکه دالتون فرض نموده بود که اتم ها ذرات تفکیک ناپذیری هستند، آزمایشهای انجام شده اوایل قرن گذشته نشان دادکه اتم ها خودشان شامل ذرات هستند. این آزمایشها نشان دادکه یک اتم حاوی دو نوع ذره است: یک هسته، هسته مرکزی اتم، که بار مثبت و بیشتر جرم اتم را دارد، و دیگری یک یا چند الکترون است. یک الکترون یک ذره بار منفی، خیلی سبک است که در ناحیه اطراف هسته بار مثبت اتم مرکزی وجود دارد.
کشف الکترون
در 1897 فیزیکدان بریتانیایی جی. جی. تامسون (شکل 1) با انجام یک سری آزمایشها نشان داد که اتم ها ذرات تفکیک ناپذیر نیستند. شکل 2 یک دستگاه آزمایش مشابه استفاده شده توسط تامسون را نشان می دهد. در این دستگاه، دو الکترود با منبع ولتاژ بالا به یک لوله شیشه ای خالی از هوا چسبیده است. الکترود منفی کاتد و الکترود مثبت آند نامیده شده اند. وقتی جریان ولتاژ-بالا روشن شده است، لوله شیشه ای نور سبز را منتشر می کند. آزمایشها نشان داد که این نور سبز با بر همکنش شیشه با اشعه های کاتدی، که اشعه های بوجود آمده از کاتد هستند، ایجاد شده است.

شکل 1
ژوزف جان تامسون
توانایی علمی جی. جی. تامسون زود با انتصابش به عنوان پروفسور آزمایشگاه کاوندیش دانشگاه کمبریج وقتی که وی هنوز 28 سالش نبود، تشخیص داده شد. بلافاصله پس از این انتصاب، تامسون تحقیق روی تخلیه الکتریکی گازها را شروع کرد. این کار با کشف الکترون در 1897 به اوج رسید. تامسون در 1909 برنده جایزه نوبل در فیزیک شد.
بعد از اینکه اشعه کاتدی، الکترود منفی را ترک کرد، و بسوی آند حرکت کرد، مقداری از اشعه از روزنه برای تشکیل پرتو عبور می کند (شکل 2). این پرتو از صفحه بار منفی دور و به طرف صفحه دارای بار مثبت خم می شود. (اشعه کاتدی بطور مستقیم مرئی نیست، ولی مواد معینی نظیر روی سولفید باعث تابش آن شده و در نتیجه شما می توانید آن را ببینید.) شکل 2 یک آزمایش مشابه را نشان می دهد، که اشعه کاتدی به صورت خمیده دیده می شود وقتی که یک آهنربا بسوی آن برده می شود. تامسون نشان داد که خصوصیات اشعه کاتدی از نوع جنس ماده سازنده کاتد مستقل است. با چنین سندی، او نتیجه گیری کرد که اشعه کاتدی شامل پرتوی از ذرات باردار منفی (یا الکترون ها) می شود و الکترون ها جز اصلی همه مواد هستند.
یک لوله تلویزیون از انحراف اشعه کاتدی با میدان مغناطیسی استفاده می کند. پرتوی از اشعه کاتدی به صفحه پوشش داده شده روی جلوی لوله، جاییکه با تغییر دادن مغناطیس تولید شده با سیم پیچ های الکترومغناطیسی هدایت می شود، پرتو تصویر درخشان را ترسیم می کند.
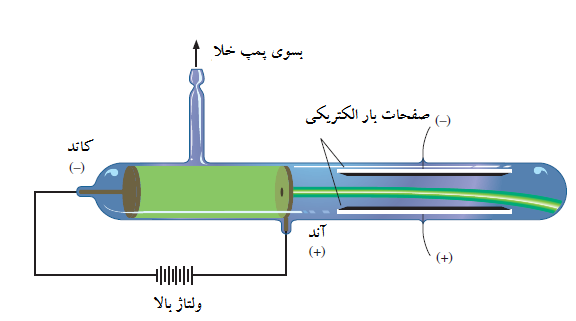
شکل 2
تشکیل اشعه کاتدی
اشعه کاتدی، کاتد یا الکترود منفی را ترک می کند، و بسوی آند یا بار مثبت شتاب گرفته است. مقداری از اشعه از روزنه آند برای تشکیل پرتو عبور کرده، در نهایت با صفحات الکتریکی در لوله منحرف شده است.
تامسون همچنین از آزمایشش توانست نسبت جرم الکترون، me، به بار الکتریکی الکترون، e را حساب کند. گر چه وی نتوانست هم جرم و هم بار را بطور جداگانه ای بدست بیاورد. در 1909 فیزیکدان ایالات متحده رابرت ملیکان با یک سری آزمایشهای مبتکرانه توانست بار الکترون را با مشاهده چگونگی پایین آمدن قطره روغن باردار در حضور یا عدم حضور میدان الکتریکی (شکل 3) بدست آورد. از این نوع آزمایش، بار الکترون 19-10×1/602 کولن (کولن، مخففش C، واحد بار الکتریکی است) بدست آمد. اگر شما از این با مقدار اخیر نسبت جرم به بار الکترون استفاده نمایید، شما جرم یک الکترون را k 9/109 × 10-31 kg بدست می آورید، که 1800 برابر کوچکتر از سبکترین اتم (هیدروژن) است. این خیلی واضح نشان می دهد که الکترون در حقیقت یک ذره زیر اتمی است.
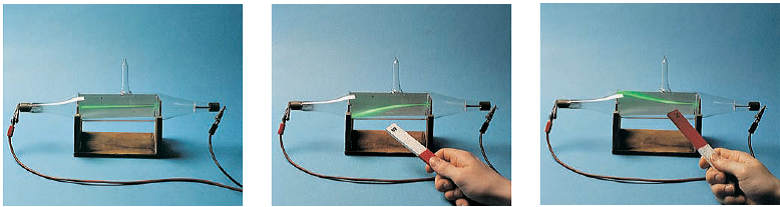
شکل3
انحراف اشعه کاتدی با آهنربا
چپ: پرتو اشعه کاتدی از راست به چپ می رود. پرتو وقتی روی سطح سولفید روی می افتد مرئی است. وسط: اشعه ذرات منفی بسوی قطب جنوب آهنربای نزدیک شده به آن خم می شود. راست: وقتی آهنربا تغییر جهت می دهد پرتو در جهت مخالف خم می شود.
شکل 4
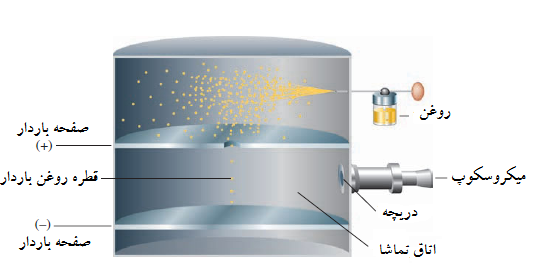
آزمایش قطره-روغن میلیکان
یک عطر پاش، یا بطری اسپری مه خالصی از قطرات روغن را وارد اتاق سربی بالایی می کند. قطرات متعدد بوجود آمده از طریق روزنه کوچک به اتاق سربی پایین افتاده، محلی که آزمایش با تعقیب حرکت قطره با میکروسکوپ ادامه می یابد. تعدادی از این قطرات در اثر اصطکاک با عطر پاش دارای یک یا چند الکترون و بار منفی هستند. قطره با بار منفی به سمت بالا جذب خواهد شد اگر آزمایش کننده جریان الکتریکی بین صفحات را روشن کند. سرعت بالا رفتن قطره (بدست آمده از زمان بالا رفتنش) بستگی به نسبت جرم به بار آن دارد، وشما می توانید بار الکترون را حساب کنید.
فرضیه های نظریه اتمی دالتون
نکته های اصلی نظریه اتمی دالتون، توضیحی از ساختار ماده با اصطلاحی از ترکیب های متفاوت از ذرات خیلی ریز است، که با فرضیه های ذیل ارائه شده اند:
1. همه مواد از اتم های غیر قابل تفکیک تشکیل شده اند. یک اتم یک ذره خیلی کوچکی از ماده است که در هنگام واکنش شیمیایی هویت خود را حفظ می کند
2. یک عنصر نوعی از ماده است که فقط از یک نوع اتم تشکیل شده است، هر اتم از نوع معین خواص یکسانی دارند. جرم یکی از این خواص است. بدین ترتیب، اتم های یک عنصر مشخص جرم خاصی دارند.
3. یک ترکیب نوعی ماده است که از اتم های دو یا چند عنصر به صورت شیمیایی با نسبت های ثابت تشکیل شده است. اعداد نسبی هر دو نوع اتم در یک ترکیب در نسبت های ساده وجود دارد، برای مثال، آب، ترکیبی از عنصرهای هیدروژن و اکسیژن با نسبتهای 2 به 1 است.
4. یک واکنش شیمیایی آرایش مجدد اتم های موجود در اجسام واکنش دهنده برای بدست آمدن ترکیبات شیمیایی جدید حاضر در اجسام تشکیل شده با واکنش است. در واکنش شیمیایی اتم ها نه بوجود می آیند، نه از بین می روند، نه به ذرات کوچکتر تفکیک می شوند.
امروزه ما می دانیم که تفکیک نا پذیری اتم ها صحیح نیست و خود اتم از ذرات ریز تشکیل شده است.
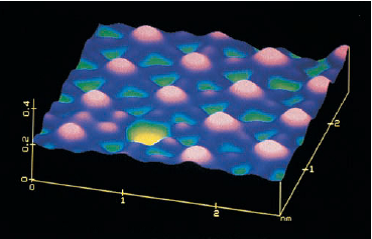
تصویر اتم های ید در سطح فلز پلاتین
این تصویر سطحی رایانه ای یا میکروسکوپ عبوری روبشی بدست آمده است؛ رنگ با رایانه به تصویر اضافه شده است. اتم های ید با قله های بزرگ صورتی هستند.