حرف اصلی نظریه اتمی دالتون ایده ای بود که یک اتم یک عنصر جرم مشخصی دارد. ما حالا می دانیم که عناصر طبیعی موجود مخلوطی از ایزوتوپها هستند، هر ایزوتوپ دارای جرم خاص خودش است. گرچه، درصد ایزوتوپهای مختلف در اغلب عناصر طبیعی موجود بطور اساسی با مرور زمان ثابت باقی مانده و در اغلب موارد از منبع عنصر مستقل است. بدین ترتیب، جرمی که دالتون عملا محاسبه کرد میانگین جرمهای اتمی بود (عملا میانگین جرمهای نسبی، که ما بحث خواهیم کرد). از آنجاییکه شما بطور معمولی با مخلوط طبیعی موجود عناصر سرو کار دارید (خواه در شکل خالص خواه به شکل ترکیبات)، در حقیقت شما به میانگین جرمهای اتمی در کار شیمیایی نیاز خواهید داشت.
برخی تغییر ترکیب ایزوتوپی در تعدادی عناصر رخ می دهد و این اهمیت میانگین جرم اتمی آن را محدود می کند.
جرمهای اتمی نسبی
دالتون نتوانست اتم تنهایی را وزن کند. وی چطور می توانست میانگین جرم یک اتم را نسبت به میانگین جرم یک اتم دیگر بیابد. ما این جرمهای اتمی نسبی را به صورت جرمهای اتمی در نظر خواهیم گرفت. برای اینکه ببنید دالتون چطور جرمهای اتمی را بدست آورد، فرض کنید شما گاز هیدروژن را در اکسیژن می سوزانید. محصول این واکنش آب ، که ترکیبی از هیدروژن و اکسیژن است. در آزمایش، شما بدست آوردید که 1/0000 گرم از هیدروژن با g 7/9367 اکسیژن برای تشکیل آب واکنش می دهد. برای بدست آوردن جرم اتمی اکسیژن (نسبت به هیدروژن)، شما به فهمیدن نسبت تعداد اتمهای هیدروژن به تعداد اتمهای اکسیژن در آب نیاز دارید. همانطوریکه که ممکن است شما فرض کنید، دالتون با این مشکل داشت. امروزه ما می دانیم که آب دارای دو اتم هیدروژن برای یک اتم اکسیژن است. بنابراین جرم اتمی اکسیژن 873/ 15=7/9367 ×2 برابر میانگین جرم اتم هیدروژن است.
دالتون فرض کرد که فرمول آب HO است. با استفاده از این فرمول و اطلاعات دقیق او وزن میانگین اتمی اکسیژن را 7/9367 بدست آورده بود.
واحدهای جرم اتمی
سرانجام مقیاس جرم اتمی بر پایه هیدروژن دالتون با مقیاس بر پایه اکسیژن و سپس، در 1961، با مقیاس جرم کربن-12 فعلی جایگزین شد. این مقیاس به اندازه گیری جرم اتمی با دستگاهی بنام طیف سنج جرمی، که ما آن را بطور خلاصه در بخش بعدی توضیح خواهیم داد، بستگی دارد. شما اندازه گیری دقیق جرمها را با این دستگاه با مقایسه کردن جرم یک اتم به جرم یک اتم خاص انتخاب شده به عنوان استاندارد انجام می دهید. با مقیاس جرم اتمی فعلی، ایزوتوپ کربن-12 به عنوان استاندارد اتنخاب شده است و بطور قراردادی 12 برای واحد جرم اتمی تعیین شده است. بنابراین، واحد جرم اتمی (amu) واحد جرم برابر با یک دوازدهم جرم یک اتم کربن-12 است.
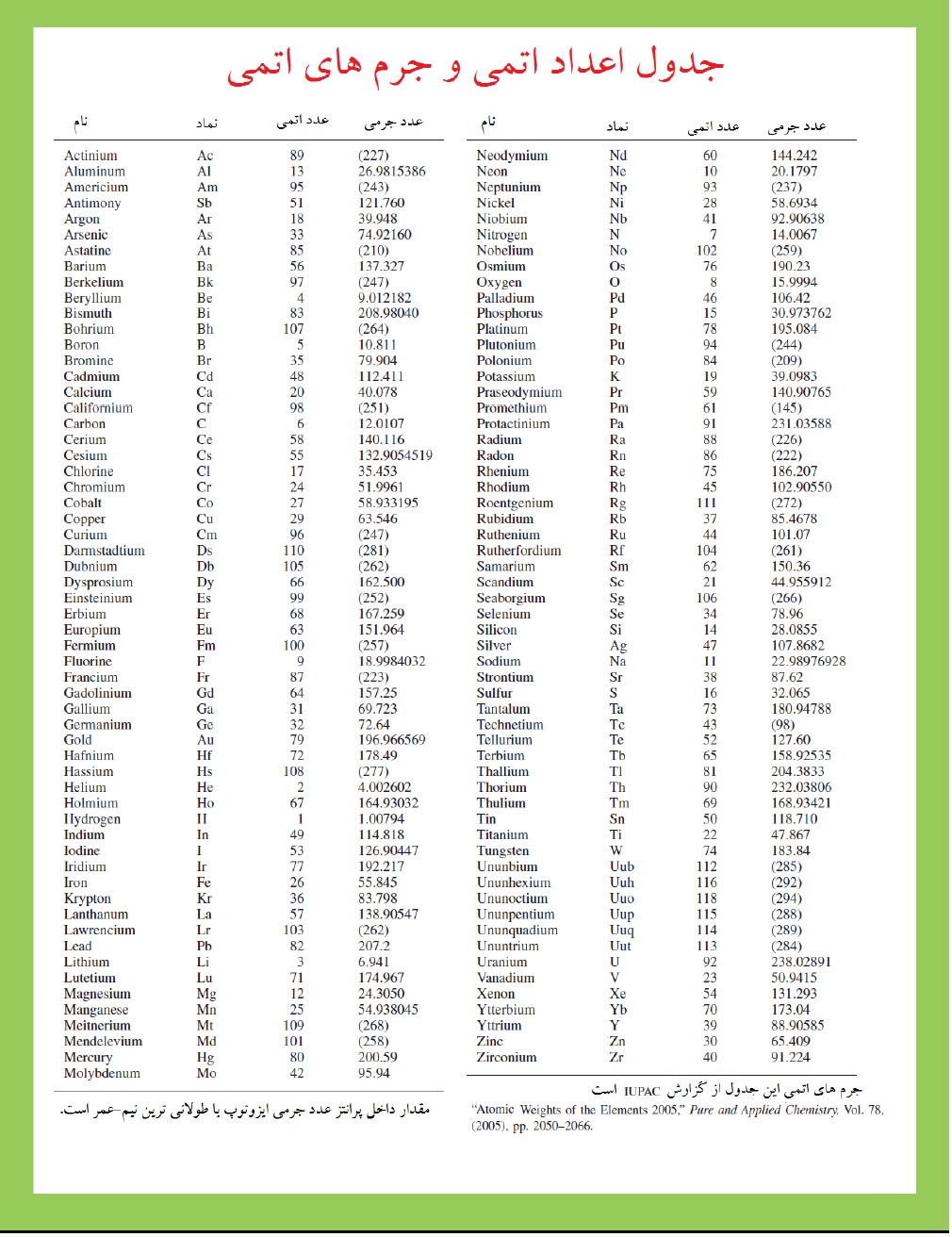
در این مقیاس جدید، جرم اتمی یک عنصر میانگین جرم اتمی عنصر طبیعی موجود، بیان شده در واحد جرم اتمی است. جدول کامل جرمهای اتمی در ذیل آمده است. (جرم اتمی بعضی وقتها با وزن اتمی بیان می شود. گرچه، استفاده از اصطلاح وزن در وزن اتمی اکیدا صحیح نیست، با قرارداد به معنی "میانگین جرم اتمی" مجاز شده است.)

عالی بود. مرسی. خیلی از ابهامات رو از بین برد