قبل از اینکه ساختار پایه اجسام شیمیایی بنا نهاده شود، ترکیبات با نام افراد، محلها، و خواص ویژه نامگذاری شده بودند. برای نمونه نمک گلوبر (سدیم سولفات، کشف شده توسط جی. آر. گلوبر)، نمک آمونیاک (آمونیوم کلرید، برگرفته شده از نام خدای باستانی مصری آمون از معبد نزدیک مکان بوجود آمده جسم)، و سودا شوینده (سدیم کربنات، استفاده شده برای نرم کردن آب شستشو) را می توان ذکر کرد. امروزه میلیونها ترکیبات متعدد شناخته شده اند و هزاران ترکیب دیگر نیز سالانه کشف می شوند. بدون یک سیستم نامگذاری ترکیبات، نوشتن نام ، با این زیادی اجسام یک وظیفه نا امید کننده خواهد شد. نامگذاری شیمیایی نامگذاری سیستماتیک ترکیبات شیمیایی است.
اگر یک ترکیب در تقسیم بندی آلی قرار نگیرد، آن ترکیب بایستی معدنی باشد. ترکیبات معدنی ترکیبات عناصر دیگر غیر از کربن هستند. تعداد کمی استثنا در این شکل طبقه بندی شامل کربن مونو کسید، کربن دی اکسید، کربناتها، و سیانیدها می شوند؛ که همگی دارای کربن هستند و بطور کلی هنوز جزو معدنی ها محسوب می شوند.
در این بخش، ما در مورد نامگذاری تعدادی از ترکیبات معدنی ساده بحث خواهیم کرد. در ابتدا ما به نامگذاری ترکیبات یونی، بعد از آن، به تعدادی از ترکیبات مولکولی ساده، شامل ترکیبات مولکولی دوتایی (ترکیبات مولکولی دو عنصری) و اسیدها، و در نهایت، به هیدراتهای ترکیبات یونی خواهیم پرداخت. هیدراتهای ترکیبات یونی دارای مولکولهای آب آزاد همراه با ترکیبات یونی هستند.
همانطوریکه ما در بخش قبلی دیدیم، ترکیبات یونی، اجسامی هستند که از یونها تشکیل شده اند. اغلب ترکیبات یونی شامل اتمهای یک فلز و یک غیر فلز، برای مثال،NaCl می شوند. (نمکهای آمونیوم، مانند NH4Cl، یک استثنا برجسته هستند.) شما نامگذاری یک ترکیب یونی را با نامیدن کاتیون آن در اول و سپس آنیون آن در ادامه انجام می دهید. برای مثال،
پتاسیم سولفات
نام کاتیون نام آنیون
قبل از اینکه شما بتوانید ترکیبات یونی را نامگذاری کنید، شما باید توانایی نوشتن نام یونها را داشته باشید.
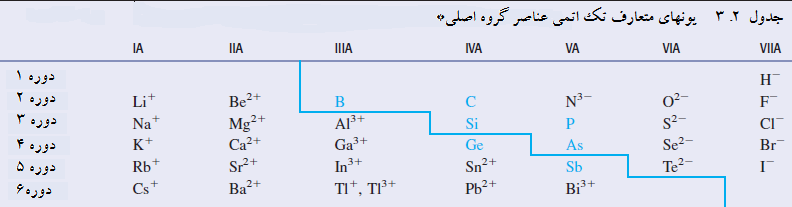
ساده ترین یونها تک اتمی هستند. یک یون تک اتمی یونی تشکیل شده از یک اتم است. جدول یونهای تک اتمی معمول عناصر گروه اصلی را فهرست کرده است. قبل از اینکه شما به جدول نگاه کنید اول شما با قواعد پیشگویی بار روی چنین یونهایی و سپس به قواعد نامگذاری یونهای تک اتمی آشنا شوید.
قواعد پیشگویی بار یونهای تک اتمی
1. اغلب عناصر فلزی گروه اصلی یک کاتیون تک اتمی با بار برابر شماره گروه در جدول تناوبی (عدد رومی) را دارند. مثال: آلومینیوم، در گروه IIIA، یون تک اتمی Al3+ دارد.
2. تعدادی از عناصر فلزی با عدد اتمی بالا از قاعده قبلی استثنا هستند؛ آنها بیش از یک کاتیون دارند. این عناصر علاوه بر داشتن کاتیون با بار برابر شماره گروه، کاتیون متعارف با بار برابر شماره گروه منها 2 را نیز دارند. مثال: کاتیون متعارف سرب Pb2+ است. (شماره گروه 4 است؛ بار 2-4 است.) علاوه بر ترکیبات دارای Pb2+، برخی ترکیبات سرب دارای Pb4+ هستند.
3. اغلب فلزات واسطه بیش از یک کاتیون تک اتمی با بار متفاوت تشکیل می دهند. بیشتر این عناصر یک یون با بار 2+ دارند. مثال: آهن کاتیونهای متعارف Fe2+ و Fe3+ را دارد. مس کاینونهای متعارف Cu+ و Cu2+ را دارد.
4. بار آنیون تک اتمی برای یک عنصر غیر فلزی گروه اصلی برابر با شماره گروه منهای 8 است. مثال: اکسیژن آنیون تک اتمی O2- را دارد. (شماره گروه 6 است: بار 8-6 است.)
عناصر نشان داده شده رنگی ترکیبات یونهای تک اتمی ندارند.
یک طبقه مهم از اجسام مولکولی ترکیبات آلی هستند که کربن ترکیب شده با سایر عناصر، نظیر هیدروژن، اکسیژن، و نیتروژن دارند. شیمی آلی بخشی از شیمی است که با این ترکیبات در ارتباط است . از نظر تاریخی، ترکیبات آلی از موادی که فقط از موجود زنده می توانستند تولید بشوند، محدود شده بودند و فرض شده بود که با توجه به منبع طبیعیشان دارای "نیروی حیاتی" هستند. وقتی شیمیدان آلمانی، فردریش وهلر اوره (ترکیب مولکولی در ادرار انسان، CH4N2O، شکل1) را از ترکیب مولکولی آمونیاک (NH3) و سیانیک اسید (HNCO) سنتز کرد، مفهوم نیروی حیاتی در 1828 رد شد. کار وی بطور روشنی ثابت کرد که یک ترکییب معین خواه از موجود زنده بدست آمده یا سنتز شده باشد، دقیقا یکی است.
شکل 1
مدل مولکولی اوره (CH4N2O)
اوره اولین مولکول آلی توسط یک شیمیدان از ترکیبات غیر آلی سنتز شد.
ترکیبات آلی قسمت عمده همه ترکیبات شناخته شده را می سازند. از 1975، بیش از 13 میلیون (60%) اجسام ثبت شده در ثبت مواد بین المللی با عنوان آلی فهرست شده است. شما هر روز با ترکیبات آلی هم در مواد زنده و هم در مواد غیر زنده مواجه می شوید. پروتئینها، آمینو اسیدها، آنزیمها، و DNA که سازنده بدن شما هستند همگی یا مولکولهای آلی یا حاوی مولکولهای آلی هستند. شکر خوراکی، روغن بادام زمینی، داروهای آنتی بیوتیکی، و متانول (شوینده شیشه جلوی ماشین) همگی مولکولهای آلی هستند. شیمی آلی و ترکیبات بوجود آمده با واکنشهای مولکولهای آلی احتمالا تشکیل دهنده اکثریت مواد موجود در اطراف شما در حال خواندن متن این صفحه هستند.
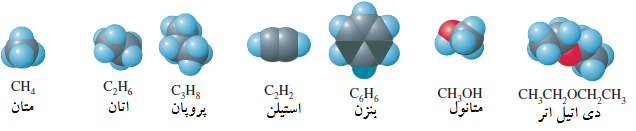
ساده ترین ترکیبات آلی هیدروکربنها هستند. هیدروکربنها ترکیباتی هستندکه فقط دارای هیدروژن و کربن هستند. مثالهای عادی شامل متان (CH4)، اتان (C2H6)، پروپان (C3H8)، استیلن (C2H2)، و بنزن (C6H6) هستند. هیدروکربنها اغلب به عنوان منبع انرژی برای گرم کردن خانه ها، سوخت موتورها، و تولید برق استفاده شده اند. همچنان هیدروکربنها مواد آغازین برای اغلب پلاستیکها هستند. قسمت اعظم تحرک و راحتی تمدن فعلی ما بر اساس قیمت پایین و وجود هیدرو کربنها بنا شده است.
شیمی مولکولهای آلی اغلب با گروه اتمهای موجود در مولکول که خواص منحصر بفردی دارند، تعیین شده است. یک گروه عاملی یک قسمت واکنش پذیر مولکول است که واکنشهای قابل پیشگویی را انجام می دهند. وقتی شما از اصطلاح الکل، که یک ترکیب مولکولی است، استفاده می کنید، شما در عمل یک مولکول شیمیایی که یک گروه عاملی OH- را دارد مد نظر دارید. متیل الکل فرمول شیمیایی CH3OH دارد. واژه اتر یک مولکول آلی دارای یک اتم اکسیژن بین دو اتم کربن، همانند دی اتیل اتر (CH3CH2OCH2CH3) را نشان می دهد. جدول 1 چندین مثال از گروههای عاملی آلی همراه با مثال ترکیبات را نشان می دهد.
جدول 1 مثالهایی از گروههای عاملی آلی |
|
||
گروه عاملی |
نام گروه عاملی |
نمونه مولکول |
استفاده عمومی |
-OH |
الکل |
متیل الکل (CH3OH) |
شوینده شیشه ماشین |
-O- |
اتر |
دی متیل اتر (CH3OCH3) |
حلال |
-COOH |
کربوکسیلیک اسید |
استیک اسید (CH3COOH) |
اسید سرکه |
بررسی مفهوم
تشخیص دهید که کدام یک ازترکیبات ذیل می توانند هیدروکربن، الکل، اتر، یا کربوکسیلیک اسید باشند؟
اگر چه اکثر اجسام مولکولی هستند، ولی بقیه از یونها تشکیل شده اند. یک یون یک ذره باردار است که از یک اتم یا گروهی از اتمهای متصل شده شیمیایی با اضافه شدن یا حذف الکترون بدست آمده است. سدیم کلرید جسم ساخته شده از یونها است.
گر چه اتمهای مجزا بطور عادی الکتریکی خنثی هستند و بنابراین تعداد مساوی از بارهای مثبت و منفی دارند، در موقع تشکیل ترکیبات معین اتمها می توانند یون بشوند. اتمهای فلزات تمایل بدست دادن الکترونها دارند، در حالیکه نا فلزات تمایل به گرفتن الکترون را دارند. وقتی یک اتم فلز نظیر سدیم و یک اتم نافلز نظیر کلر به یکدیگر نزدیک می شوند، یک الکترون می توانداز اتم فلز به اتم نا فلز برای تشکیل یونها منتقل می شود.
یک اتم که یک الکترون بیرونی را می گیرد یک یون با بار منفی می شود، که آنیون نامیده می شود. یک اتم که یک الکترون را می دهد یک یون با بار مثبت می شود، که کاتیون نامیده می شود. بطور مثال، اتم سدیم برای تشکیل کاتیون سدیم (Na+) می تواند یک الکترون بدهد. یک اتم کلر برای تشکیل آنیون کلرید (-Cl) می تواند یک الکترون بگیرد. یک اتم کلسیم می تواند برای تشکیل کاتیون کلسیم Ca2+ دو الکترون بدهد. توجه شود که دو بار مثبت روی یون با بالا نویس +2 نشان داده شده است.
بعضی از یونها دو یا چند اتم متصل شده شیمیایی دارند اما دارای زیادی یا کمبود الکترون هستند، در نتیجه واحد بار الکتریکی دارد. یک مثال، یون سولفات، SO42- است. بالا نویس -2 دو الکترون اضافی را روی گروه اتمها را نشان می دهد.
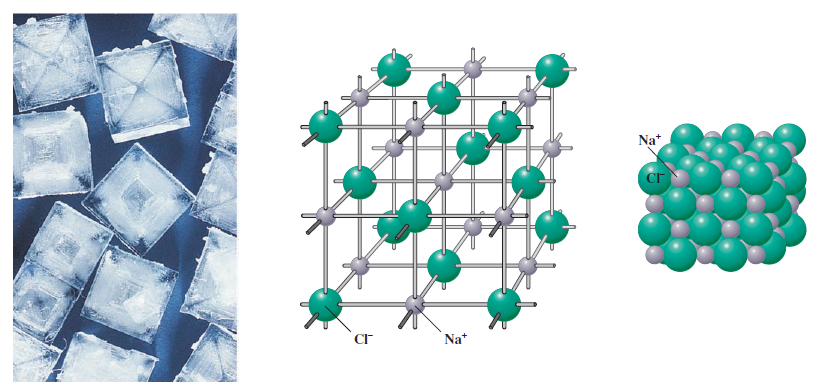
یک ترکیب یونی ترکیب تشکیل شده از کاتیونها و آنیونها است. سدیم کلرید تعداد مساوی از یونهای، Na+، و یونهای کلرید، -Cl، را دارد. نیروی جاذبه بین بارهای منفی و مثبت یونها را باهم با ارایش منظم در فضا کنار هم نگه می دارد. برای مثال، در سدیم کلرید، هر یون Na+، با شش یون –Cl و هر یون –Cl با شش یون Na+، احاطه شده است. نتیجه، یک بلور است، که نوعی جامد دارای آرایش سه بعدی منظم از اتمها، مولکولها، یا (در مورد سدیم کلرید) یونها است. شکل 1 بلورهای سدیم کلرید و دو نوع مدل استفاده شده برای نشان دادن آرایش یونها در بلور را نشان می دهد. تعداد یونها در بلور سدیم منحصر بفرد اندازه بلور را تعیین می کند.
فرمول ترکیب یونی با مشخص کردن کوچکترین عدد صحیح ممکن یونهای مختلف در جسم ، با حذف بار یونها است، بنابراین فرمولها فقط اتمهای موجود را نشان می دهد. برای مثال، سدیم کلرید تعداد مساوی از یونهای Na+ و –Cl را دارد. فرمول NaCl (نه –Cl Na+ ) نوشته می شود. آهن(III) سولفات ترکیبی است از یونهای آهن(III)،+Fe3، و یونهای سولفات، SO42-، به نسبت 2:3 است. فرمول به صورت Fe2(SO4)3 است، که پرانتزها فرمول یک ترکیب یونی بیش از یک اتم (بعلاوه بار یونها حذف شده است) را در برمی گیرد؛ پرانتزها فقط وقتی که دو یا چند تا یون این چنینی وجود دارد نیاز است.
شکل
بلور سدیم کلرید
چپ: تصاویر نشان دهنده بلورهای سدیم کلرید. وسط: مدل بخشی از بلور با آرایش منظم یونهای سدیم و یونهای کلرید. هر یون سدیم با شش یون کلرید، و هر یون کلرید با شش یون سدیم احاطه شده است. راست: مدل مشخصی از آرایش یونهای سدیم و کلرید در بلور سدیم کلرید جامد
گر چه اجسام یونی مولکول ندارند، ما می توانیم ما از کوچکترین واحد چنین جسمی صحبت بکنیم. واحد فرمولی یک جسم گروهی از اتمها یا یونها که بطور روشنی در فرمول نمادینه شده است. برای مثال، واحد فرمولی آب، H2O، مولکول H2O است. واحد فرمولی آهن(III) سولفات، Fe2(SO4)3 شامل دو یون +Fe3 و سه یون SO42- می شود. واحد فرمولی کوچکترین واحد چنین جسمی است.
همه اجسام، شامل ترکیبات یونی، از نظر الکتریکی خنثی هستند. شما از این واقعیت می توانید برای بدست آوردن فرمول ترکیب یونی، با توجه به فرمول یونها را بدست آورید. در مثال ذیل این مطلب نشان داده شده است.