ساختار هسته ای؛ ایزوتوپ ها
هسته یک اتم هم ساختار دارد؛ هسته از دو نوع ذره مختلف، پروتونها و نوترونها تشکیل شده است. الگوی آزمایش پراکندگی ذرات آلفا علاوه بر اینکه منجر به مدل هسته ای اتم شد، برای روشن شدن این ساختار هسته هم مفید شد.
یک خاصیت مهم هسته بار الکتریکی آن است. یک روش برای تعیین مقدار بار مثبت هسته آنالیز توزیع پراکندگی ذرات آلفا از ورقه فلزی است؛ همچنین آزمایشهای دیگر بار هسته را فراهم می نماید. محققین، با چنین آزمایشهایی کشف کردند که هر عنصر بار هسته ای منحصر بفردی دارد که برابر با حاصلضرب یک عدد صحیح در مقدار بار الکترون است. این عدد صحیح، که مختص یک عنصر است، عدد اتمی (Z) نامیده شده است. هسته اتم هیدروژن، که دارای مقدار بار برابر با الکترون است، کوچکترین عدد اتمی 1 را دارد.
در 1919، رادرفورد کشف کرد که هسته هیدروژن، یا آن چیزی که ما حالا پروتون می نامیم، در موقع برخورد ذرات آلفا به بعضی عناصر سبکتر نظیر تیتروژن تشکیل می شود. یک پروتون یک ذره هسته ای دارای بار مثبت برابر با بار الکترون و جرمش 1800 برابر جرم الکترون است. وقتی یک ذره آلفا به اتم نیتروژن برخورد می کند، یک پروتون از هسته نیتروژن بیرون می آید. پروتونها در هسته به هسته بار مثبت می دهد.
بنابراین عدد اتمی (Z) تعداد پروتونها در هسته یک اتم است. به علت اینکه شما می توانید بطور آزمایشگاهی عدد اتمی را تعیین کنید، شما می توانید بطور دقیقی تعیین کنید که یک نمونه یک عنصر خالص است یا شاید شما یک عنصر جدید را کشف کرده باشید. حالا ما می توانیم تعریفی از یک عنصر را با دقت زیادی بیان کنیم. یک عنصر جسمی است که همه اتم هایش عدد اتمی یکسانی را دارند.
همچنین نوترون با آزمایشهای پراکندگی ذرات آلفا کشف شده است. وقتی فلز بریلیم تحت تابش اشعه آلفا قرار گرفته است، یک تابش نافذ از فلز بدست آمده است. فیزیکدان بریتانیایی جیمز چادویک (1974-1891) نشان داد که این تابش نافذ حاوی ذرات خنثی، یا نوترون هاست. نوترون یک ذره هسته ای دارای جرم یکسان پروتون را دارد ولی بار الکتریکی ندارد. وقتی ذرات آلفا به هسته اتم برخورد می کند، نوترون ها بیرون رانده می شوند. جدول 2. 1 جرم ها و بارهای الکترون و ذرات هسته ای، پروتون و نوترون را مقایسه می کند.
جدول 2. 1 خواص الکترون، پروتون، و نوترون
ذره (kg) جرم (amu )* (C) جرم (e) بار
الکترون 31-10×10939/9 19-10×60218/1- 0/00055 l1-
پروتون 27-10×67262/1 19-10×60218/1+ 1/00726 1+
نوترون 27-10×67493/1 0 1/00866 0
*واحد جرم اتمی (amu) برابر با kg1/66054 ×10-27 است.
حالا هسته چند اتم، بطور مثال سدیم موجود طبیعی را در نظر بگیرید. هسته دارای 11 پروتون و 12 نوترون است. بدین ترتیب، بار هسته سدیم e11+ است، که ما معمولا بطور ساده ای 11+ می نویسیم که به معنی 11 واحد بار الکترون e است. بطور مشابهی آلومینیم موجود طبیعی دارای 13 پروتون و 14 نوترون است، که بار مثبت هسته e13+ است.
ما یک هسته را با عدد اتمی (Z) و عدد جرمیش (A) مشخص می کنیم. عدد جرمی (A) عدد کل پروتونها و نوترونها در هسته است. هسته سدیم طبیعی موجود عدد اتمی 11 و عدد جرمی 23 (12+11) دارد.
هسته یک اتم با عدد اتمی و عدد جرمی مشخص می شود. نماد مختصر نویسی شده برای هر هسته حاوی نماد عنصر با عدد اتمی نوشته شده به صورت زیر نویس در چپ و عدد جرمی به صورت بالا نویس در چپ است. شما نماد هسته ای برای هسته سدیم موجود طبیعی را به صورت ذیل می نویسید.
یک اتم معمولا بطور الکتریکی خنثی است، بنابراین الکترون های اطراف هسته اتم به تعداد پروتونهای هسته اتم است: که تعداد الکترونها در یک اتم خنثی برابر عدد اتمی است. یک اتم سدیم هسته اش بار 11+ دارد، و اطراف این هسته 11 الکترون (با بار 11-، اتم با بار 0) وجود دارد.
همه هسته های اتم عناصر خاص عدد اتمی یکسان دارند، ولی ممکن است هسته اتم عدد جرمی متفاوت داشته باشد. ایزوتوپها اتم هایی هستند که هسته های اتم عدد اتمی یکسان ولی اعداد جرمی متفاوت دارند؛ که هسته به تعداد یکسان پروتون دارد، ولی تعداد نوترونها متفاوت است. سدیم فقط یک ایزوتوپ موجود طبیعی دارد، که ما همان نماد که برای هسته استفاده کردیم، مشخص می کنیم؛ همچنین ما آن را ایزوتوپ سدیم-23 می نامیم. اکسیژن موجود طبیعی مخلوطی از ایزوتوپ ها است: حاوی 99/759% اکسیژن-16، 0/037%اکسیژن-17، و 0/204% اکسیژن-18 است.
ایزوتوپ ها برای اولین بار در حدود 1912 مورد شک قرار گرفتند وقتی عناصر شیمیایی یکسان با عدد های جرمی متفاوت در مواد رادیواکتیو پیدا شده بودند. گرچه، مدرک خیلی متقاعد کننده از طیف سنج جرمی، بدست آمده بود.
شکل زیر ممکن است به شما برای تجسم کردن ارتباط میان ذرات زیر اتمی متفاوت در ایزوتوپهای یک عنصر کمک کند. اندازه هسته ها نشان داده شده در شکل به منظور نشان دادن تعداد پروتونها و نوترونها خیلی بزرگنمایی شده است. در حقیقت، فضای گرفته شده با هسته در مقایسه با ناحیه اشغال شده با الکترونها کوچک است. گرچه، الکترونها ذرات خیلی سبک هستند، در کل نسبتا ناحیه پخش شده بزرگ، یا "لایه های" اطراف هسته یک اتم حرکت می کنند.
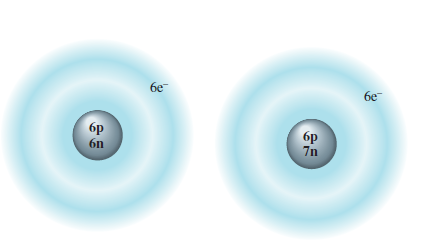
شکل 2. 9
نمایشی از دو ایزوتوپ کربن
شکل ذرات اصلی سازنده ایزوتوپهای کربن-12 و کربن-13 را نشان می دهد. (اندازه های نسبی در اینجا خیلی بزرگنمایی شده است.)

